von Yuhao Zeng 1,*, Satoshi Komasa 1 [OrcID] , Hisataka Nishida 2, Akinori Agariguchi 1, Tohru Sekino 2 [OrcID] und Joji Okazaki 1
Int. J. Mol. Sci. 2020, 21(10), 3533; https://doi.org/10.3390/ijms21103533
Abstrakt
Die alkalibehandelte Titanatschicht mit Nanonetzwerkstrukturen (TNS) ist eine vielversprechende Oberfläche zur Verbesserung der Osseointegrationskapazität in Implantaten. Dennoch besteht die Gefahr eines Geräteausfalls aufgrund unzureichender Beständigkeit gegen Biofilmkontamination. Diese Studie testete, ob die Behandlung mit einem tragbaren nicht-thermischen Plasmagerät die Biofilmkontamination effizient beseitigen kann, ohne die Oberflächennanostruktur zu zerstören und gleichzeitig eine Oberfläche wies, die eine neue Knochengeneration förderte. TNS-Proben wurden mit einem piezoelektrischen Direktentladungs-Plasmagenerator (PDD) behandelt. Die Wirkung der Dekontamination wurde mit Staphylococcus aureus durchgeführt. Die Bewertung der anfänglichen Zellbindung mit Adhäsionsbildern, alkalischer Phosphataseaktivität, extrazellulärer Matrixmineralisierung und Expression von Genen im Zusammenhang mit der Osteogenese wurde unter Verwendung von mesenchymalen Stammzellen des Knochenmarks von Ratten durchgeführt, und die Knochenreaktion wurde in vivo mit einem Rattenfemurmodell bewertet. Nanotopographie und Oberflächenrauheit unterschieden sich vor und nach Plasmabehandlungen nicht signifikant. Die Zell- und Knochenbildungsaktivität wurde durch TNS-Plasmabehandlung verbessert. Darüber hinaus eliminierte die Plasmabehandlung effektiv Biofilmkontaminationen von der Oberfläche. Diese Ergebnisse deuten darauf hin, dass diese Plasmabehandlung ein vielversprechender Ansatz für die Behandlung von Nanomaterialien unmittelbar vor der Implantation und eine therapeutische Strategie für Periimplantitis sein könnte.
1. Einleitung
Titan ist aufgrund seiner hervorragenden mechanischen Eigenschaften, Korrosionsbeständigkeit und Biokompatibilität eines der am häufigsten verwendeten Materialien für orthopädische und zahnärztliche Implantate [1,2]. Dennoch ist die Verwendung von Titanimplantaten durch das Risiko periimplantischer Infektionen, eine verlängerte Osseointegrationsheilungszeit und unzureichende osteokonduktive Eigenschaften, insbesondere bei Patienten mit Osteoporose, begrenzt [3]. Die klinischen Langzeiterfolgsraten von Titan-basierten Implantaten liegen bei 89,23% bzw. 82,94% nach 10 bzw. 16-jährigen Nachbeobachtungszeit [4]. Um die klinische Langzeiterfolgsrate von Implantaten weiter zu erhöhen, sind die Förderung einer frühen Osseointegration, Langzeitstabilität der Knochen-Implantat-Schnittstelle und eine reduzierte Periimplantitis erforderlich [2,5,6]. Die physikalischen und chemischen Eigenschaften der Implantatoberfläche spielen eine entscheidende Rolle bei der Knochenbildung im Frühstadium rund um Implantate [7].
Aufgrund der Anfälligkeit der passiven Oxidschicht und ihrer Elektrischen Leitfähigkeit wurden in den letzten drei Jahrzehnten Implantatoberflächenmodifikationen wie Sandstrahlen [8], Säureätzen [9], Oxidation [10] und Calciumphosphatabscheidung (allein oder in Kombination) [11,12] durchgeführt, um die Rauheit, mikro- und nanoskalige Merkmale und die chemische Zusammensetzung der Implantatoberfläche zu transformieren; diese Modifikationen können eine hohe Biokompatibilität vermitteln und die frühe Knochenbildung um die Implantate herum fördern [13,14,15].
Unsere bisherigen Forschungen zeigen, dass auf der Titanoberfläche nach hochkonzentrierter alkalischer Behandlung eine homogene, hydrophile Natriumtitanatschicht mit Nanonetzstrukturen (TNS) erzeugt wird [16]. TNS hat im Vergleich zu Ti eine höhere Rauheit und Hydrophilie und ist daher besser kompatibel mit der Protein- und Zellbindung sowie der Hydroxylapatitbildung; diese Faktoren führen zu einer ausgezeichneten osteogenen Aktivität [17]. Dennoch müssen noch einige Herausforderungen vor ihrer klinischen Anwendung gelöst werden. Genauer gesagt ist alkalibehandeltes Titan mit Nanostrukturen immer noch unzureichend in Bezug auf die Resistenz gegen die bakterielle Bindung und Biofilmbildung, die schließlich eine Periimplantitis verursachen kann [18], und schneller ist die Osseointegration noch eine Voraussetzung im frühen Stadium der Implantation.
Plasma ist einer der vier fundamentalen Zustände der Materie und wird als neutrales ionisiertes Gas definiert, das aus Teilchen in permanenter Wechselwirkung besteht, zu denen Photonen, Elektronen, positive und negative Ionen, Atome, freie Radikale und angeregte oder nicht angeregte Moleküle gehören. Plasma konnte bei Atmosphärendruck durch verschiedene Techniken wie Hochfrequenzplasmen [RF)-Plasmen [19], Dielektrische Barriereentladungen (DBD) Plasmen [20], Koronaentladungsplasmen [21], Gleitlichtbogenentladungsplasmen [22,23] erhalten werden. Als Folge der Produktion von reaktiven Sauerstoff- und Stickstoffspezies (RONS) wurde die Plasmabehandlung verwendet, um Verunreinigungen zu entfernen und Implantatoberflächen Hydrophilie zu verleihen, was wiederum die Protein- und Zelladhäsion fördert [24,25]. Laut Lee et al. verringert die Plasmabehandlung die bakterielle Anhaftung durch Kohlenstoffreinigung der Implantatoberfläche und reduziert dadurch das Risiko einer Implantatinfektion [26]. Das durch plasmabehandlung erzeugte RONS könnte die Biofilm-Rekolonisierung auf der Implantatoberfläche dekontaminieren und hemmen, ohne die aufwendige Oberflächengeometrie des Implantats zu zerstören, und gleichzeitig die Befestigung und Differenzierung von Osteoblasten fördern [23,25,27,28]. Die Plasmabehandlung ist ungiftig, bei niedrigen Temperaturen, sicher und hat eine hohe Behandlungseffizienz, wodurch sie für klinische Anwendungen besser geeignet ist als andere Sterilisationsmethoden. Die Verwendung eines tragbaren, nichtthermischen, atmosphärischen Plasmageräts, das piezoelektrische Technologie verwendet, hat sich kürzlich auf medizinische Anwendungen konzentriert. Da es eine höhere Verarbeitungseffizienz aufwies und umweltfreundlicher ist als UV-, Laser- und andere Arten der Plasmabehandlung, ist das nichtthermische atmosphärische Plasmagerät sehr praktisch für die sofortige Behandlung vor der Implantation. Gleichzeitig eignet sich dieses nichtthermische atmosphärische Plasma, das Biofilm eliminieren und gleichzeitig Oberflächeneigenschaften zuweisen könnte, die für die Knochenregeneration förderlich sind, besonders für die Behandlung der Periimplantitis [29].
In der vorliegenden Studie stellten wir die Hypothese auf, dass die nichtthermische atmosphärische Plasmabehandlung die chemischen Komponenten auf der Implantatoberfläche verändern und die Rauheit der durch Alkalibehandlung festgestellten nanostrukturierten Oberfläche erhalten könnte, wodurch die Osseointegration und Dekontamination gefördert wird. Um diese Hypothese zu beweisen, untersuchten wir die Wirkung der Plasmabehandlung auf die Biofilmbildung, Zelladhäsion und Osseointegration im frühstadium der Implantation durch In-vivo- und In-vitro-Experimente. Staphylococcus aureus wurde verwendet, um die Wirkung der Plasmabehandlung auf die Dekontamination zu veranschaulichen. Die Plasmabehandlung von TNS veränderte effektiv die chemische Zusammensetzung auf der Probenoberfläche, was die Hydrophilie des Implantats weiter verbesserte und die Zellanhaftung und osteogene Differenzierung erleichterte, während der Biofilm dekontaminiert wurde, ohne die Nanomorphologie der TNS-Oberfläche zu zerstören. Die Plasmabehandlung hat potenzielle klinische Anwendungen, wie die sofortige Behandlung vor der Implantation und die therapeutische Behandlung der Periimplantitis.
2. Ergebnisse2.1. Oberflächencharakterisierung
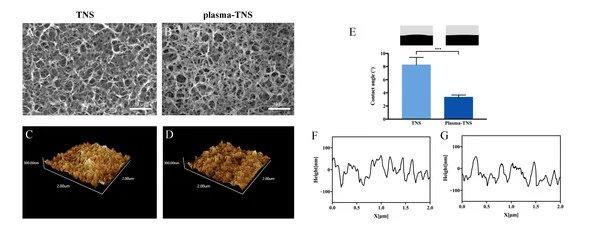
Die Rasterelektronenmikroskopie (REM), die einen wesentlichen Beitrag zur Beobachtung und Charakterisierung der Nanomorphologie geleistet hat, wurde zur Untersuchung der Oberflächentopographie von TNS- und Plasma-TNS-Proben eingesetzt. REM-Mikroaufnahmen zeigten, dass die nanoporöse Netzwerkstruktur innerhalb eines durchschnittlichen Durchmessers von 50–100 nm nach der Alkalibehandlung auf der Titanoberfläche gut vernetzt und homogen war. Wie in Abbildung 1gezeigt, veränderte sich die nanoporöse Struktur der Probenoberfläche nach der Plasmabehandlung nicht signifikant. Die Wirkung der Plasmabehandlung auf die Oberfläche, gemessen mittels Rasterkraftmikroskopie (AFM), zeigte ähnliche Nanotopographien auf den Oberflächen von TNS- und Plasma-TNS-Proben (Abbildung 1). Darüber hinaus zeigten die mit AFM gemessenen Werte der Oberflächenrauheit (Ra und Rz), dass es keinen signifikanten Unterschied zwischen TNS- und Plasma-TNS-Proben gab (Tabelle 1). Die Hydrophilieanalyse der Oberfläche von TNS- und Plasma-TNS-Proben zeigte, dass die TNS-Oberfläche hydrophile Eigenschaften mit einem Kontaktwinkel von etwa 9° aufwies. Bemerkenswerterweise wurde eine signifikante Veränderung der Benetzbarkeit an der Oberfläche von Plasma-TNS-Proben mit einem Kontaktwinkel von <3° erkannt, die superhydrophile Eigenschaften aufwiesen(Abbildung 1E).
Die chemische Zusammensetzung und chemische Bindung auf TNS- und Plasma-TNS-Oberflächen wurde mittels Röntgenphotoelektronenspektroskopie (XPS) untersucht. Umfassende XPS-Spektren der Proben ergaben, dass die chemische Oberflächenzusammensetzung die charakteristischen Peaks von Ti, O, C, N und Na enthielt. Um die Veränderungen der chemischen Zusammensetzung und der chemischen Bindung nach der Plasmabehandlung weiter zu untersuchen, wurden hochenergetische Spektren für C1s, O1s, N1s und Ti2p erhalten. Ti 2p3/2 und Ti 2p1/2 Komponenten wurden bei 458,5 eV bzw. 464,2 eV mit einem Spin-Orbital-Spaltwert von 5,7 eV gezeigt, der mit dem Ti übereinstimmt4+ Valenzzustand. Die Na1s-Spektren von TNS- und Plasma-TNS-Proben unterschieden sich nicht signifikant, was darauf hindeutet, dass beide Probentypen von Titanit abgedeckt wurden. Dies entsprach den Ergebnissen früherer Studien [30]. Das Vorhandensein von Kohlenstoffkontamination auf allen Oberflächen war offensichtlich, was auch mit früheren Studien übereinstimmte [31]. Bemerkenswerterweise nahm das Kohlenstoffverhältnis auf der Probenoberfläche nach der Plasmabehandlung signifikant ab. Abbildung 2 zeigt das Verhältnis von N/Ti zu O/Ti auf der Oberfläche von TNS- und Plasma-TNS-Proben. Die Verhältnisse zeigten den deutlichen Anstieg des O- und N-Gehalts auf der Oberfläche von plasmabehandelten Proben.
Hochenergetische Spektren des N1s-Peaks vor und nach der Plasmabehandlung sind in Abbildung 2F dargestellt. Die unterschiedlichen Spektren, die an plasmabehandelten Proben beobachtet wurden, wurden bei einer Bindungsenergie von 406,8 eV gezeigt, was NO entspricht.x (Nitrat)Arten [32,33]. Im Gegensatz dazu wurden nur wenige dieser Spektren auf der Oberfläche unbehandelter Proben gefunden. Abbildung 2 zeigt auch die hochauflösenden Sauerstoff-1s-Spektren von der Oberfläche von TNS- und Plasma-TNS-Proben. Nach Moulder et al. [32] zeigt die Dekonvolution des O1s-Peaks drei verschiedene Sauerstoffatomzustände. Die Komponente, die sich bei der Bindungsenergie von 530,3 eV (O1) befindet, entspricht Sauerstoff O2− im TiO2 Gitterstruktur; die Komponente bei 531,4 eV (O2) ist oft mit -OH-Gruppen verwandt; Die Komponente bei 532,7 eV (O3) ist typischerweise mit NO assoziiertx oder H2O-Gruppen [34].
XPS-Spektren der TNS-Oberfläche zeigten, dass der größte Teil des Sauerstoffs in Form eines Oxids (O1) gebunden war und der Anteil der -OH-Bindungen kleiner war(Abbildung 2G). Dies deutet im Allgemeinen darauf hin, dass Sauerstoffatome eher TiO bilden.2 auf der Probenoberfläche. Im Gegensatz zur TNS-Oberfläche wurde auf der Oberfläche von Plasma-TNS-Proben eine große Anzahl von O2-Komponenten beobachtet. Diese waren mit der -OH-Gruppe verwandt und wurden durch die Wechselwirkung energetischer reaktiver Sauerstoffspezies zwischen dem Plasma und der Materialoberfläche verursacht. Infolgedessen wurde die Hydrophilie der Materialoberfläche signifikant verbessert, was mit den Messergebnissen des Kontaktwinkels übereinstimmt. Die wichtige O3-Komponente, die typischerweise mit NO verbunden istx Gruppen wurden auf der Oberfläche von Plasma-TNS-Proben nachgewiesen; Dies war darauf zurückzuführen, dass die reaktiven Stickstoffspezies (RNS) die Gasphasenchemie während der Plasmabehandlung dominierten [35,36].
2.2. Biofilm-Dekontamination
Um die Effizienz der Dekontamination durch Plasmabehandlung zu beurteilen, wurde die Staphylococcus aureus (S. aureus) Kultur 24 h lang auf der Oberfläche von TNS inkubiert und zu einem Biofilm entwickeln lassen. Die Oberflächen wurden dann einer Plasmabehandlung ausgesetzt. Die Ergebnisse der Inaktivierung zeigen, dass eine Plasmabehandlung die Lebensfähigkeit von S. aureus signifikant verringern könnte (Abbildung 3).
2.3. Bestimmung der intrazellulären reaktiven Sauerstoffspezies (ROS)
Darüber hinaus war, wie in Abbildung 4gezeigt, der Intrazellulär-ROS-Gehalt auf der Oberfläche von TNS signifikant höher als auf der Oberfläche von Plasma-TNS-Proben nach Inkubation für 24 h, während es keinen signifikanten Unterschied in der Anzahl der anhaftenden Zellen zwischen beiden Oberflächentypen gab.
2.4. Zelladhäsion und Morphologie
Nach 24 h Inkubation zeigte die Zellmorphologiefärbung mit Phalloidin und DAPI, dass die Zellen, die an plasmabehandelten Oberflächen hafteten, eine höhere Zellfläche aufwiesen als diejenigen, die an unbehandelten Oberflächen hafteten(Abbildung 5A–E). Die Zunahme der anfänglichen Zelladhäsion und die Veränderungen in der Zellmorphologie trugen wahrscheinlich zur Superhydrophilie der durch die Plasmabehandlung erzeugten Oberfläche [37] in Übereinstimmung mit den Ergebnissen der Hydrophilieanalyse bei. Darüber hinaus wurde der CellTiter-Blue Cell Viability Assay verwendet, um die Adhäsion von mesenchymalen Stammzellen (rBMMSCs) des Knochenmarks an TNS- und Plasma-TNS-Proben zu bewerten. Die Ergebnisse zeigten eine höhere Anzahl von Zellen, die nach 1, 3 und 6 h an der Oberfläche von Plasma-TNS-Proben hafteten(Abbildung 5F).®
2.5. Osteogene Aktivität mesenchymaler Stammzellen des Knochenmarks der Ratte (rBMMSCs)
Die ALP-Aktivität, die ein biochemischer Marker für die Osteoblastenaktivität und den Zellphänotyp im Frühstadium der Zelldifferenzierung und Knochenbildung ist, war in der Plasma-TNS-Gruppe nach sieben und 14 Tagen höher als in der TNS-Gruppe(Abbildung 6A). Im Vergleich zur TNS-Gruppe zeigte die Plasma-TNS-Gruppe nach 21 und 28 Tagen eine höhere Calciumablagerung (ein Marker für eine extrazelluläre Matrixmineralisierung)(Abbildung 6B). Die Genexpression des knochenmorphogenetischen Proteins (BMP) und des Osteocalcins (OCN), die repräsentative osteogene Differenzierungsprodukte sind, war in Zellen, die auf Plasma-TNS gezüchtet wurden, signifikant höher als in solchen, die auf TNS-Proben kultiviert wurden(Abbildung 6C,D). Diese Ergebnisse zeigten, dass die Differenzierungsaktivität von rBMMSCs durch mit Plasma behandelte Oberflächen signifikant gefördert wurde.
2.6. Bewertung der Knochenmorphogenese um das Implantat in vivo
Die Knochenbildungsaktivität um das TNS-Implantat und das Plasma-TNS-Implantat wurde mit einem Rattenfemurmodell bewertet. Im Bereich der Plasma-TNS-Oberfläche wurde mehr trabekuläre Mikroarchitektur beobachtet als in der der TNS-Oberfläche (Abbildung 7). Darüber hinaus war das Verhältnis von Knochenvolumen zu Gesamtvolumen (BV/TV), mittlere trabekuläre Zahl (Tb.N) und mittlere trabekuläre Dicke (Tb.Th) in den Plasma-TNS-Proben signifikant höher, was darauf hindeutet, dass die plasmabehandelten Implantate die Osteogeneseaktivität förderten (p < 0,01). Die mittlere trabekuläre Trennung (Tb.Sp) war im Plasma-TNS-Implantat niedriger als im TNS-Implantat (p < 0,01).
Des Weiteren wurde ein Längsschnitt verwendet, um die neue Knochenbildung um das Implantat herum zu bewerten. Wie in Abbildung 8gezeigt, wurde neu gebildeter Knochen um das Plasma-TNS-Implantat herum beobachtet als das TNS-Implantat. Quantitativ zeigte die histomorphometrische Analyse, dass das Knochenflächenverhältnis (BA) und der Knochen-Implantat-Kontakt (BIC) um die Plasma-TNS-Implantate signifikant höher waren als um die TNS-Implantate(Abbildung 8E,F). Darüber hinaus wurde der neu gebildete Knochen um das Implantat nach einer Woche mit Oxytetracyclinhydrochlorid (blau), nach vier Wochen mit Alizarinrot S (rot) und nach acht Wochen mit Calcein (grün) markiert. Der markierte Knochenbereich zwischen der Implantatschnittstelle und dem markierten Knochenbereich in den Wochen 1, 4 und 8 war bei Plasma-TNS-Implantaten signifikant höher als bei TNS-Implantaten(Abbildung 8G–I).
3. Diskussion
Die Oberflächenmorphologie und chemische Zusammensetzung auf der Oberfläche mit Nanostrukturen aus Titan spielen eine entscheidende Rolle bei der Nachahmung von natürlichem Knochengewebe und Weichteilen, um den Knochenheilungsprozess zu fördern, was in der Literatur ausführlich berichtet wurde [15]. Nach unseren vorherigen Experimenten verbesserten die homogenen nanoporösen Strukturen auf der Titanoberfläche, die durch Alkalibehandlung erzeugt wurden, die Osseointegration und trugen zu ihrer hervorragenden Hydrophilie und Rauheit im Vergleich zu reinem Titan bei [16,17]. Dennoch ist die Resistenz nanostrukturierter Oberflächen gegen Biofilm immer noch unzureichend, was zu einer Periimplantitis und schneller zur Osseointegration führen könnte, die im frühen Stadium der Implantation noch erforderlich ist. In der vorliegenden Studie wurde nicht-thermisches Atmosphärendruckplasma verwendet, um die nanostrukturierte Oberfläche zu modifizieren, und die Wirkung der Förderung der osteogenen Aktivität und Dekontamination wurde umfassend bewertet.
Nach den von REM und AFM beobachteten Nanotopographien zeigten die Probenoberflächen eine ähnliche homogene nanoporöse Netzwerkstruktur, unabhängig davon, ob sie mit Plasma behandelt wurde oder nicht, was darauf hindeutet, dass die Plasmabehandlung die Geometrie der Nanostruktur auf der Probenoberfläche nicht zerstört und dadurch die positive Wirkung der Nanostruktur auf die Osseointegration erhalten bleiben könnte. Darüber hinaus bestätigte die XPS-Analyse, dass sich die chemische Zusammensetzung auf der Probenoberfläche nach der Plasmabehandlung signifikant verändert hat. Verglichen mit der Oberfläche von TNS bildet sich nach der Plasmabehandlung eine große Anzahl polarer Sauerstoffgruppen (wie Hydroxyl-, Carbonyl- und Carboxylgruppen), die ihre Hydrophilie verstärken könnten [35]. Dies steht im Einklang mit der Analyse des Kontaktwinkelexperiments, das feststellt, dass die Hydrophilie der Plasma-TNS-Oberfläche weiter verbessert wurde. Gleichzeitig wurde der Anstieg von NOx nach der Plasmabehandlung auch durch XPS-Analyse nachgewiesen und kann auf das übermäßige Gasphasen-RNS zurückzuführen sein, das vom Plasma erzeugt wird [38].
Darüber hinaus wurden die Abnahme des Kohlenstoffs und die Bildung von RONS nach der Plasmabehandlung beobachtet und als mit der Wirksamkeit der Dekontamination und der Hemmung der frühen Bakterienbindung und Biofilmbildung zusammenhängend angesehen [39,40,41,42]. Während der Plasmadekontamination sind Bakterien direkt der Plasmafahne ausgesetzt, die aus reichlich vorhandenen RONS besteht, die Membranveränderungen und Enzymhemmung induzieren, Änderungen in Membrantransportproteinen auslösen, was zur Ansammlung von mehr RONS führt, was letztendlich zu physiologischen Funktionsstörungen und Zelltod führt [43,44]. Darüber hinaus zeigten die Ergebnisse des Dekontaminationsexperiments, dass die Plasmabehandlung, die auf die biofilmkontaminierte nanostrukturierte Oberfläche angewendet wird, den Biofilm effektiv eliminieren kann, ohne die Nanostruktur der Oberfläche zu zerstören. Darüber hinaus zeigten Lee et al., dass eine Plasmabehandlung die Kohlenstoffkontamination verringern könnte, um eine hydrophile Oberfläche zu bilden, wodurch die Resistenz gegen bakterielle Anhaftung verbessert und die Rekolonisierung von Biofilmen gehemmt wird, was aus klinischer Sicht sehr vorteilhaft wäre [26].
Nach den Ergebnissen des Zelladhäsionsexperiments induzierte die Plasmabehandlung keine Zellapoptose und förderte sogar die Zellbindung im frühen Stadium der Inkubation [45]. Die Analyse der Zellmorphologie ergab höhere Zellbereiche auf Oberflächen, die einer Plasmabehandlung unterzogen wurden, die wahrscheinlich zum erhöhten hydrophilen Charakter von plasmabehandelten Proben beitragen [46]. Darüber hinaus wurde die Verbesserung der osteogenen Differenzierungsfähigkeit von Zellen durch die Ergebnisse der ALP-Aktivität, der Calciumablagerung und der Knochenmorphogenetik protein 2 und der Osteocalcin-Genexpression nachgewiesen. Gleichzeitig ergaben Tierversuche, dass die Plasmabehandlung umfassend zur Förderung der neuen Knochengeneration und Osseointegration beitrug. Nach den Mikro-CT-, histologischen Abschnitts- und Fluoreszenz-Markierungsanalysen hatte die Plasmabehandlung einen signifikant positiven Effekt auf die Förderung der Osteogenese. Insbesondere erzeugte die Plasmabehandlung Oberflächen, die die Bildung von neuem Knochengewebe in den Wochen 1 und 4 nach der Implantation stark förderten, zur Osteogenese beitrugen und die Implantatstabilität bestätigten. Diese Eigenschaften spielen eine entscheidende Rolle für den Implantationserfolg im frühen Stadium der Implantation und unsere Ergebnisse unterstützen somit zukünftige Forschungsmöglichkeiten, diese vielversprechenden Eigenschaften zu nutzen und zu nutzen.
Die Ergebnisse der XPS-Analyse zeigten, dass die Plasmabehandlung die chemische Zusammensetzung auf der Oberfläche signifikant veränderte und zu einer Zunahme polarer Sauerstoffgruppen (wie Hydroxyl, Carboxylgruppen usw.) führte. Des Weiteren bevorzugen wir es, die Einflüsse dieser erhöhten Sauerstofffunktionsgruppen auf die an der plasmabehandelten Oberfläche gebundenen Zellen zu untersuchen. Die Forschung zur Stammzellbiologie in den letzten Jahrzehnten hat sich darauf konzentriert, dass eine übermäßige intrazelluläre ROS-Akkumulation Proteine, Lipide, DNA schädigen und schließlich zur Zellapoptose führen könnte [47,48], gleichzeitig eine Vielzahl von antioxidativen und Anti-Stress-Mechanismen von Stammzellen geklärt haben [49,50]. Dennoch gibt es immer mehr Hinweise auf die Meinung, dass intrazelluläre ROS bei der Redox-Homöostase unter Umständen eine entscheidende Rolle bei der Aufrechterhaltung der Selbsterneuerung von Stammzellen spielt [51]. Tatsächlich befinden sich Stammzellen in einem Zustand, der durch niedrige Spiegel von intrazellulärem ROS gekennzeichnet ist, die für die Regulierung des Potenzials zur Selbsterneuerung und Stemness entscheidend sind, während hohe Mengen an intrazellulärem ROS die Fähigkeit von Stammzellen zur Selbsterneuerung und Differenzierung effektiv hemmen [52,53,54]. Darüber hinaus reduzierte laut Ueno et al. berichtet, titanische Oberfläche, die mit UV-Licht vorbehandelt wurde, signifikant das intrazelluläre ROS und die Expression entzündlicher Zytokine, so dass die oxidative Stress-induzierte DNA-Schädigung verhindert und die Zelladhäsion gefördert und verbreitet wurde [55]. Folglich kann die Untersuchung des Zusammenhangs zwischen intrazellulären ROS-Spiegeln und veränderten chemischen Eigenschaften nach der Plasmabehandlung Einblicke in den Mechanismus geben, durch den die Plasmabehandlung die Osseointegration im frühen Stadium der Implantation fördert. Wie die Ergebnisse gezeigt haben, weisen Zellen, die an der plasmabehandelten Oberfläche befestigt sind, ein geringeres Niveau an intrazellulärem ROS auf als diejenigen auf der unbehandelten Oberfläche, während die osteogene Aktivität zunimmt. Vor kurzem haben Gómez-Puerto et al. gezeigt, dass sauerstofffunktionelle Gruppen die Phosphorylierung von Gabelkopfbox O3 (FOXO3) an Serin 294, die durch MAPK8-Kinase vermittelt wurde, und deren Translokation in den Kern induzieren können. Gleichzeitig führt die Aktivierung von FOXO3 zur Herunterregulierung der intrazellulären ROS durch die Aktivierung der Autophagie zur Aufrechterhaltung der Redox-Homöostase während der osteoblastischen Differenzierung [56]. Darüber hinaus könnte die Überexpression des FOXO3-Gens in Osteoblasten oxidativen Stress und Osteoblasten-Apoptose verringern und die Knochenbildungsrate erhöhen [57]. Wir stellten die Hypothese auf, dass die sauerstofffunktionellen Gruppen auf der plasmabehandelten Oberfläche die Phosphorylierung von FOXO3 aktivieren könnten, um den oxidativen Stresszustand herunterzuregulieren, was einer der möglichen Mechanismen der erhöhten osteogenen Aktivität nach der Plasmabehandlung zu sein scheint. Weitere Experimente werden in Zukunft durchgeführt, um zu bestätigen, ob die bessere osteogene Aktivität, die in der Plasma-TNS-Gruppe beobachtet wird, auf die Abnahme des intrazellulären ROS zurückzuführen ist, die durch sauerstofffunktionelle Gruppen induziert wird, die die Phosphorylierung von FOXO3 vermitteln.
Zusammenfassend wurde gezeigt, dass die Plasmabehandlung bemerkenswert zur Verbesserung der osteogenen Aktivität und zur Dekontamination der Oberfläche beitragen kann. Durch die Bewertung der Oberflächeneigenschaften und die Biofilmdekontamination bestätigten wir, dass die Plasmabehandlung die Kontamination beseitigen kann, ohne die vorteilhafte Nanostruktur der Oberfläche zu zerstören. Nach den Ergebnissen des osteogenen Aktivitätsexperiments sowohl in vitro als auch in vivo haben wir auch überprüft, dass die Oberfläche nach der Plasmabehandlung für die Verbesserung der Osteoblastendifferenzierung und der frühen osteogenen Aktivität sehr vorteilhaft ist. Aufgrund der hervorragenden Wirkung der gleichzeitigen Wiederherstellung einer hochhydrophilen Oberfläche, die für die Osseointegration und Beseitigung des Biofilms geeignet ist, und der klinisch freundlichen Vorteile der Plasmabehandlung, wie Handarbeit, reibungsloser Betrieb, niedrige Kosten, wird erwartet, dass die weit verbreitete Anwendung von Plasma entweder als Behandlung unmittelbar vor der Implantation oder als therapeutische Strategie für Periimplantitis günstig ist. Darüber hinaus zeigte diese Studie, dass die Rauheit der nanostrukturierten Oberfläche durch die Plasmabehandlung nicht verändert wurde, was für die kombinierte Anwendung dieser Plasmabehandlung und anderer Materialien mit der Nanostruktur von großer Bedeutung sein könnte. In zukünftigen Experimenten werden wir auch ein Infektionstiermodell etablieren und die Wirksamkeit der Plasmabehandlung auf infizierten Implantaten als neuartige therapeutische Strategie für Periimplantitis umfassend bewerten.
4. Materialien und Methoden4.1. Probenvorbereitung
Reine Titanscheiben der Klasse 2 (15 mm Durchmesser und 1 mm Dicke) und Titanschraubenimplantate (1,2 mm Außendurchmesser und 12 mm Länge) wurden durch mechanische Bearbeitung (Daido Steel, Osaka, Japan) zur Bewertung der Oberflächeneigenschaften bzw. für die Tierstudie hergestellt. Die Platten wurden dann mit inkrementellen SiC-Schleifpapieren (800#, 1000# und 1500#) poliert. Alle Proben wurden mit Aceton, Ethanol und entionisiertem Wasser (jeweils 10 min) ultraschallgespült und über Nacht bei Raumtemperatur getrocknet. Alle Proben wurden 24 h lang in eine 10 M NaOH-Lösung bei 30 °C getaucht, mehrmals mit ionengewechseltem Wasser (200 ml) gewaschen, bis die Leitfähigkeit der Lösung 5 μS/cm erreichte.3und dann über Nacht bei Raumtemperatur getrocknet, um poröse, homogene und gleichmäßige Nanonetzwerkstrukturen (TNS) auf der Titanoberfläche zu etablieren.
4.2. TNS-Plasmabehandlung
Die Plasmabehandlung wurde mit einem nicht-thermischen Atmosphärendruck-Handplasmagerät (Piezobrush PZ2®, Relyon Plasma GmbH, Regensburg, Deutschland), die piezoelektrische Direktetladungstechnologie verwendete. Die Hälfte der Proben wurde bei Raumtemperatur mit Plasma behandelt, das durch aktives Gas bei Atmosphärendruck für 30 s induziert wurde. Der Abstand zwischen dem Strahlausgang und den Proben wurde auf 5 mm eingestellt, um sicherzustellen, dass die Proben vollständig in die aus der Düse austretende Plasmafahne eingetaucht waren. Plasmabehandeltes TNS wurde in der experimentellen Gruppe getestet, während die Kontrollgruppe unbehandelt war.
4.3. Oberflächencharakterisierung
TNS und Plasma-TNS Oberflächentopographie wurden von SEM (S-4800, Shimadzu, Kyoto, Japan) mit 10 kV Beschleunigungsspannung ausgewertet. AFM (SPM-9600, Shimadzu Co., Tokio, Japan) wurde verwendet, um die mittlere durchschnittliche Oberflächenrauheit (Ra), die mittlere Peak-to-Valley-Höhe (Rz), die Oberflächenprofile und die dreidimensionale Oberflächentopographie der Proben zu bestimmen. Die chemische Zusammensetzung der Probe wurde durch XPS (Kratos Axis Ultra, Shimadzu, Japan) bestimmt. Die Benetzbarkeit der Probenoberfläche wurde mit einem Kontaktwinkelmesssystem (VSA 2500 XE; AST Products, Billerica, MA, USA).
4.4. Biofilm-Dekontamination
Die S. aureus-Kultur wurde aus einer einzigen Kolonie hergestellt, die in 5 ml Tryptic Soybrühe (TSB) medium geimpft und für 16 h bei 37 °C inkubiert wurde. Ein Milliliter Bakteriensuspension, die auf eine Konzentration von 1 × 10 eingestellt wurde5 CFU/ml wurde durch Zugabe von frischem TSB-Medium auf die Oberfläche von TNS zugegeben, was nach 24 h Inkubation zu einer Biofilmbildung führte. Dann wurde die Bakteriensuspension entfernt und die Proben wurden für die anschließende Plasmabehandlung vorbereitet, indem mit Phosphatpuffersalzlösung (PBS) gespült wurde, um nicht haftende Bakterien zu entfernen. Nach der Plasmabehandlung wurden die Proben in ein steriles Reagenzglas mit 5 ml TSB-Medium überführt und für 2 Minuten vortexed, um den gebildeten Biofilm zu vertreiben. Die Quantifizierung der in der Lösung enthaltenen Bakterien erfolgte mittels der Plattenzählmethode [58].
4.5. Zellkultur
Die rBMMSCs wurden aus den Oberschenkelknochen von 8 Wochen alten Sprague-Dawley-Ratten (SHIMIZU Laboratory Supplies Co., Kyoto, Japan) gewonnen. Die Zellen wurden in Wachstumsmedium kultiviert, das ein minimales essentielles Medium (Nacalai Tesque Inc., Tokio, Japan), 10% fetales Rinderserum (Nacalai Tesque Inc.) und antibiotisch-antimykotische Mischstofflösung (Nacalai Tesque Inc.) in einer 5% igen CO-Lösung enthielt.2 Befeuchteter Inkubator bei 37°C. Das Medium wurde alle 3 Tage gewechselt.
4.6. Zellmorphologie
Nach 24 h Inkubation wurden die Proben mit PBS gewaschen, durch Inkubation mit 4% Paraformaldehydlösung für 20 min fixiert, mit 0,2% (v/v) Triton X-100 für 30 min permeabilisiert, mit Blocking One Reagenz (Nacalai Tesque, Kyoto, Japan) für 30 min inkubiert und dann mit Alexa Fluor 488-Phalloidin (Invitrogen/Life Technologies) und DAPI bei 37 °C im Dunkeln für 1 h gefärbt. Ein konfokales Laserscanning-Mikroskop (LSM700; Carl Zeiss) wurde verwendet, um die F-Aktin- und Zellkerne adhärenter Zellen zu bewerten. Insgesamt 30 Zellen wurden zufällig aus drei repräsentativen Bildern ausgewählt, die pro Oberfläche von drei Proben in jeder Gruppe gemessen wurden, so der jüngste Bericht. Und die ImageJ-Software wurde für die fluoreszierende Bildanalyse verwendet.
4.7. Zellhaftung
Die rBMMSCs wurden mit einer Anfangsdichte von 4 × 10 auf die Proben ausgesät.4 Zellen/cm2 und darf für 1, 3, 6 und 24 h befestigt werden. Nach der Inkubation bei 37°C wurden die nicht haftenden Zellen durch Waschen mit PBS (Nacalai Tesque, Inc.) entfernt und mit 300 μL verdünntem CellTiter-Blue Reagenz (50 μL CellTiter-Blue Reagenz verdünnt in 250 μL PBS) kultiviert. Nach weiteren 1 h Inkubation wurde die Fluoreszenzintensität mit einem Mikroplattenleser (SpectraMax M5; Molecular Devices, Sunnyvale, CA, USA) nach dem Protokoll des Herstellers.®®
4.8. Bestimmung des intrazellulären ROS
Die Erzeugung von intrazellulärem ROS wurde unter Verwendung der oxidationsempfindlichen Fluoreszenzsonde 2′,7′-Dichlorfluoresceindiacetat (DCFH-DA, Sigma, St. Louis, MO, USA) analysiert. Nach 24 h Inkubation werden die Zellen mit PBS gewaschen und mit 10 mM DCFH-DA für 30 min bei 37 °C inkubiert. Anschließend wurden die Zellen zweimal mit PBS gewaschen, mit 50 μL Trypsin (0,25%) abgelöst und mit 50 μL PBS verdünnt. Die Fluoreszenz wurde dann bei Anregungs-/Emissionswellenlängen von 485/528 nm mit einem Fluoreszenz-Mikroplattenleser gemessen, wie vom Hersteller angegeben.
4.9. Aktivität der alkalischen Phosphatase (ALP)
Um die ALP-Aktivität zu bewerten, wurden 4 × 104 Die Zellen wurden auf Proben ausgesät und in α-MEM kultiviert, das 10% fötales Rinderserum, antibiotisches Antimykotikum, 10 mM Glycerophosphat (Wako Pure Chemical Industries, Osaka, Japan) und 10 nM Dexamethason (Nacalai Tesque) enthielt. Das Differenzierungsmedium wurde alle 3 Tage gewechselt. Nach 7 oder 14 Tagen Inkubation wurden die Proben mit PBS gewaschen und Zellen, die an der Probenoberfläche befestigt waren, mit 300 μL 0,2% Triton X-100 gelöst. Die ALP-Aktivität wurde durch ein alkalisches Phosphatase-Luminometrie-ELISA-Kit (Enzyme-Linked Immunosorbent Assay) (Sigma-Aldrich) gemäß den Anweisungen des Herstellers bewertet. Zur Bewertung des DNA-Gehalts wurde ein PicoGreen dsDNA-Analysekit (Invitrogen/Life Technologies) verwendet. Die Menge an ALP wurde auf die Menge an DNA in jedem Zelllysat normalisiert.
4.10. Extrazelluläre Matrixmineralisierung
Nach 21 oder 28 Tagen Inkubation wurde die Calciumablagerung in der extrazellulären Matrix nach Auflösung mit 10% Ameisensäure gemessen. Der Calciumgehalt wurde mit einem Calcium E-Test Kit (Wako Pure Chemical Industrials Ltd.) gemäß den Anweisungen des Herstellers quantifiziert und berechnet.
4.11. Osteogenese-bezogene Genexpression
Die Expression osteogenesebezogener Gene wurde mit einem Echtzeit-TaqMan RT-PCR-Assay (Life Technologies, Carlsbad, CA, USA) untersucht. Die Gesamt-RNA wurde mit einem RNeasy Mini Kit (Qiagen, Venlo, Niederlande) extrahiert, und 10-μL-Aliquoten jeder RNA-Probe wurden mit einem Prime Script RT Reagent Kit (TaKaRa Bio, Shiga, Japan) umgekehrt in cDNA transkribiert. Die mRNA-Spiegel osteogenesebezogener Gene für knochenmorphogenetisches Protein 2 (Bmp 2) und Knochen-Gamma-Carboxy-Glutaminsäure-haltiges Protein (OCN) wurden mit einem Step One TM Plus RT-PCR-System (Life Technologies) untersucht. Die relativen Genexpressionswerte in jeder Gruppe wurden auf die des Glyceraldehyd-3-Phosphat-Dehydrogenase-Gens (GAPDH) normalisiert.
4.12. Tiermodell und chirurgische Verfahren
Der Tierversuch wurde nach den ethischen Grundsätzen der National Animal Care Guidelines durchgeführt und von der Medizinischen Ethikkommission der Osaka Dental University, Japan, genehmigt (Zulassung Nr. 19-06002, 16. August 2019). Acht Wochen alte männliche Sprague-Dawley-Ratten (Shimizu Laboratory Supplies Co., Kyoto, Japan) mit einem Gewicht von 180-200 g wurden in dieser Studie verwendet. Die Ratten wurden nach dem Zufallsprinzip in zwei Gruppen eingeteilt, mit acht Ratten in jeder Gruppe. Die in dieser Studie verwendeten chirurgischen Verfahren wurden zuvor beschrieben [59]. Nach Vollnarkose und chirurgischer Reinigung wurde ein 10-mm-Längsschnitt entlang der medialen Seite des Kniegelenks des rechten Hinterbeins vorgenommen. Die Patella und der Streckmechanismus wurden dann ausgerenkt, um den distalen Femur freizulegen. Ein 1,2-mm-Loch wurde mit einem Zahngrat mit sterilisierter Kochsalzspülung in die interkondylaren Notch gebohrt. Schrauben wurden in die vorbereiteten Kanäle implantiert, das Kniegelenk wurde wiederhergestellt und der Schnitt wurde vernäht. Gentamicin (1 mg/kg) und Buprenorphin (0,05 mg/kg) wurden 3 Tage nach der Operation injiziert, um postoperative Infektionen zu verhindern und postoperative Schmerzen zu lindern.
4.13. Sequenzielle Fluoreszenzmarkierung und Mikrocomputed Tomographie
Die sequenzielle Polychrom-Markierung des Knochens durch intraperitoneale Injektion von Fluoreszenzfarbstoffen wurde verwendet, um den Prozess und die Eigenschaften der neuen Knochenbildung und Mineralisierung nach der Implantation nach folgendem Zeitplan zu bestimmen: Ratten wurden 25 mg/kg Oxytetracyclinhydrochlorid (Sigma-Aldrich, USA) nach 1 Woche nach der Implantation injiziert, mit 30 mg/kg Alizarinrot S (011-01192, Wako, JP) nach 4 Wochen und mit 20 mg/kg Calcein (340-00433, Wako, Japan) nach 8 Wochen. Ratten wurden dann nach 8 Wochen betäubt und eingeschläfert, und die rechten Oberschenkelknochen einschließlich der Implantate wurden unmittelbar nach der Dissektion in eine Kochsalzlösung gelegt und mit einem SMX-130CT Mikro-CT-Scanner (Shimadzu) gescannt, der bei 90 kV und 40 μA mit einem Kupferfilter betrieben wurde. Dreidimensionale Rekonstruktionsmodelle wurden mit morphometrischer Software (TRI/3D-BON; Ratoc System Engineering, Tokio, Japan). Der interessierende Bereich wurde als 2 mm unterhalb des höchsten Punktes der Wachstumsplatte definiert und erstreckt sich 500 μm um jedes Implantat. Die Knochenvolumenfraktion (BV/TV), die mittlere trabekuläre Zahl (Tb.N), die mittlere trabekuläre Dicke (Tb.Th) und die mittlere trabekuläre Trennung (Tb.Sp) wurden quantifiziert, um die Knochenregeneration zu beurteilen.
4.14. Histologie sequenziell beschrifteter Abschnitte
Nach dem Mikro-CT-Scan wurden implantierte Oberschenkelknochen, die nach 8 Wochen gesammelt wurden, mit der Villanueva-Methode zur Beurteilung der Knochenbildung gefärbt. Alle histomorphometrischen und Fluoreszenzeigenschaften der Schnitte wurden mit einem digitalen Kaltlichtmikroskop BZ-9000 (Keyence Co., Osaka, Japan) bzw. einem Laserscanningmikroskop (Carl Zeiss, Oberkochen, Deutschland) analysiert. Die Anregungs- und Emissionswellenlängen waren 351/460 nm für Oxytetracyclinhydrochlorid (blau), 543/617 nm für Alizarinrot S (rot) und 488 nm/517 nm für Calcein (grün). Knochenbereich, BIC und markierter Knochenbereich wurden mit der ImageJ-Software in einem 200× Feld um das Implantat herum bewertet.
4.15. Statistische Analyse
Alle Daten wurden als Mittelwert ± Standardabweichung ausgedrückt. Jedes Experiment wurde dreimal wiederholt, und alle Ergebnisse wurden in SPSS 26.0 durch den Student’s t-Test verglichen; P< 0,05 wurde als statistisch signifikant angesehen.
5. Schlussfolgerungen
Die Plasmabehandlung von Titanoberflächen mit Nanonetzwerken veränderte effektiv die chemische Zusammensetzung der Probenoberfläche, was die Hydrophilie des Implantats weiter verbesserte und die Zellanhaftung und -erweiterung erleichterte. signifikant beschleunigte die neue Knochenbildung und verbesserte die Osseointegration im frühen Stadium der Implantation. Darüber hinaus dekontaminierte die Plasmabehandlung effizient die Implantatoberfläche unter Beibehaltung der nanoskaligen Morphologie der TNS-Oberfläche und erzeugte gleichzeitig eine für die Osteogenese vorteilhafte Oberfläche, die als neuartiger Ansatz für die sofortige Behandlung vor der Implantation oder als therapeutische Methode der Periimplantitis verwendet werden könnte. Darüber hinaus hat die Aufklärung der Wirkung auf die Zelladhäsion, Differenzierung und Dekontamination durch Plasmabehandlung sinnvolle Ratschläge für die zukünftige Forschung und die Entwicklung plasmabasierter Therapiestrategien vermittelt.
Autorenbeiträge
A.A., T.S. und S.K. konzipierten und gestalteten die Experimente; Y.Z. führte die Experimente durch; S.K., H.N. und Y.Z. analysierten die Daten; J.O. steuerte Reagenzien/Materialien/Analysewerkzeuge bei; Y.Z. schrieb die Arbeit. Alle Autoren haben die veröffentlichte Version des Manuskripts gelesen und ihr zugestimmt.
Finanzierung
Diese Studie wurde durch ein Stipendium der Japan Society for the Promotion of Science (19K19146 und 18K09713) und der Osaka Dental University Research Funds (20-08) unterstützt.
Bestätigungen
Wir danken Tohru Sekino und Hisataka Nishida von der Osaka University für die Vorbereitung des TNS und hilfreiche Vorschläge. Wir danken Akinori Agariguchi von der Osaka Dental University für ihren positiven Rat. Wir danken auch Yasuyuki Kobayashi vom Osaka Research Institute of Industrial Science and Technology Morinomiya Center für hilfreiche Vorschläge. Wir danken auch den Mitgliedern der Abteilung für herausnehmbare Prothetik und Okklusion und der Abteilung für Parodontologie für ihre Beratung und Unterstützung.
Interessenkonflikte
Die Autoren erklären keinen Interessenkonflikt.
Referenzen
- Adell, R.; Eriksson, B.; Lekholm, U.; Brånemark, P.I.; Jemt, T. Langzeit-Follow-up-Studie von osseointegrierten Implantaten bei der Behandlung von völlig zahnlosen Kiefern. Int. J. Oral Maxillofac. Einpflanzen. 1990,5, 347–359. [Google Scholar]
- Albrektsson, T.; Brånemark, P.I.; Hansson, H.A.; Lindström, J. Osseointegrierte Titanimplantate: Anforderungen an die Gewährleistung einer lang anhaltenden, direkten Knochen-zu-Implantat-Verankerung beim Menschen. Acta Orthop. 1981,52, 155–170. [Google Scholar] [CrossRef]
- Van Steenberghe, D.; Jacobs, R.; DeSnyder, M.; Maffei, G.; Quirynen, M. Der relative Einfluss lokaler und endogener patientenbezogener Faktoren auf das Implantatversagen bis zum Abutmentstadium. Clin. Orales Implantat. Res. 2002, 13, 617–622. [Google Scholar] [CrossRef]
- Pierre, S.; Dufour, T.; Tenenbaum, H. Langfristiges Implantatüberleben und -erfolg: Eine 10-16-jährige Nachbeobachtung von nicht untergetauchten Zahnimplantaten. Clin. Orales Implantat. Res. 2010, 21, 772–777. [Google Scholar]
- Chrcanovic, B.R.; Kisch, J.; Albrektsson, T.; Wennerberg, A. Eine retrospektive Studie über klinische und radiologische Ergebnisse von oralen Implantaten bei Patienten, die mindestens 20 Jahre lang nachverfolgt wurde. Clin. Einpflanzen. Zahn. Relat. Res. 2018, 20, 199–207. [Google Scholar] [CrossRef]
- Roos-Jansåker, A.M.; Renvert, S.; Egelberg, J. Behandlung periimplantärer Infektionen: Eine Literaturübersicht. J. Clin. Parodontitis. 2003,30, 467–485. [Google Scholar] [Querverweis] [PubMed]
- Lang, N.P.; Salvi, G.E.; Huynh-Ba, G.; Ivanovski, S.; Donos, N.; Bosshardt, D.D. Frühe Osseointegration in hydrophile und hydrophobe Implantatoberflächen beim Menschen. Clin. Orales Implantat. Res. 2011, 22, 349–356. [Google Scholar] [Querverweis] [PubMed]
- Scotchford, C.A.; Gilmore, C.P.; Cooper, E.; Leggett, G.J.; Downes, S. Proteinadsorption und humane osteoblastenähnliche Zellanheftung und Wachstum auf Alkylthiol auf selbstorganisierenden Goldmonoschichten. J. Biomed. Mutter. Res. 2002,59, 84–99. [Google Scholar] [Querverweis] [PubMed]
- Wang, X.X.; Hayakawa, S.; Tsuru, K.; Osaka, A. Bioaktive Titania-Gelschichten, die durch chemische Behandlung von Ti-Substrat mit einer H2O2/ HCl-Lösung gebildet werden. Biomaterials 2002, 23, 1353–1357. [Google Scholar] [CrossRef]
- Nanci, A.; Wuest, J.D.; Peru, L.; Brunet, P.; Sharma, V.; Zalzal, S.; McKee, M.D. Chemische Modifikation von Titanoberflächen zur kovalenten Anheftung biologischer Moleküle. J. Biomed. Mutter. Res. 1998,40, 324–335. [Google Scholar] [Google Scholar] [CrossRef]
- Gambardella, A.; Bianchi, M.; Kaciulis, S.; Mezzi, A.; Brucale, M.; Cavallini, M.; Herrmannsdoerfer, T.; Chanda, G.; Uhlarz, M.; Cellini, A.; et al. Magnetische Hydroxylapatit-Beschichtungen als neues Werkzeug in der Medizin: Eine Rastersondenuntersuchung. Mutter. Sci. Eng.C 2016,62, 444–449. [Google Scholar] [Querverweis] [PubMed]
- Le Guéhennec, L.; Soueidan, A.; Layrolle, P.; Amouriq, Y. Oberflächenbehandlungen von Titan-Zahnimplantaten für eine schnelle Osseointegration. Zahn. Mutter. 2007,23, 844–854. [Google Scholar] [Querverweis] [PubMed]
- Hanawa, T. Ein umfassender Überblick über Techniken zur Biofunktionalisierung von Titan. J. Parodontal. Einpflanzen. 2011,41, 263–272. [Google Scholar] [Querverweis] [PubMed]
- Souza, J.C.M.; Sordi, M.B.; Kanazawa, M.; Ravindran, S.; Henriques, B.; Silva, F.S.; Aparicio, C.; Cooper, L.F. Nanoskalige Modifikation von Titanimplantatoberflächen zur Verbesserung der Osseointegration. Acta Biomater. 2019,94, 112–131. [Google Scholar] [CrossRef]
- Komasa, S.; Taguchi, Y.; Nishida, H.; Tanaka, M.; Kawazoe, T. Bioaktivität der Nanostruktur auf Titanoberfläche, modifiziert durch chemische Verarbeitung bei Raumtemperatur. J. Prothetik. Res. 2012, 56, 170–177. [Google Scholar] [CrossRef]
- Xing, H.; Komasa, S.; Taguchi, Y.; Sekino, T.; Okazaki, J. Osteogene Aktivität von Titanoberflächen mit Nanonetzstrukturen. Int. J. Nanomed. 2014, 9, 1741. [Google Scholar] [CrossRef]
- Hu, X.; Neoh, K.G.; Zhang, J.; Kang, E.T. Bakterien- und Osteoblastenverhalten auf Titan, Kobalt-Chrom-Legierung und Edelstahl, die mit Alkali und Hitze behandelt wurden: Eine vergleichende Studie für mögliche orthopädische Anwendungen. J Colloid Interface Sci. 2014,417, 410–419. [Google Scholar] [CrossRef]
- Koulik, P.; Begounov, S.; Goloviatinskii, S. Atmosphärische Plasmasterilisation und Desodorierung dielektrischer Oberflächen. Plasma Chem. Plasmaprozess. 1999,19, 311–326. [Google Scholar] [CrossRef]
- Fridman, A.; Chirokov, A.; Gutsol, A. Nicht-thermische atmosphärische Druckentladungen. J. Phys. D Appl. Phys. 2005, 38, R1. [Google Scholar] [CrossRef]
- Chang, J.S.; Gesetzlos, P.A.; Yamamoto, T. Corona-Entladungsprozesse. 1991, 19,1152–1166. [Google Scholar] [CrossRef]
- Benstaali, B.; Boubert, P.; Cheron, B.G.; Addou, A.; Brisset, J.L. Dichte- und Rotationstemperaturmessungen der OH- und NO-Radikale, die durch einen Gleitbogen in feuchter Luft erzeugt werden. Plasma Chem. Plasmaprozess. 2002,22, 553–571. [Google Scholar] [CrossRef]
- Moreau, M.; Orange, N.; Feuilloley, M.G.J. Nicht-thermische Plasmatechnologien: Neue Werkzeuge für die Biodekontamination. Biotechnol. Adv. 2008,26, 610–617. [Google Scholar] [Querverweis] [PubMed]
- Park, J.H.; Olivares-Navarrete, R.; Baier, R.E.; Meyer, A.E.; Tannenbaum, R.; Boyan, B.D.; Schwartz, Z. Wirkung von Reinigung und Sterilisation auf die Oberflächeneigenschaften von Titanimplantaten und die zelluläre Reaktion. Acta Biomater. 2012,8, 1966–1975. [Google Scholar] [Querverweis] [PubMed]
- Modic, M.; Kovač, J.; Nicholls, J.R.; Kos, Š.; Serša, G.; Cvelbar, U.; Walsh, J. Gezielte Plasmafunktionalisierung von Titan hemmt die polymikrobielle Biofilm-Rekolonisierung und stimuliert die Zellfunktion. Appl. Surfen. 2019,487, 1176–1188. [[url=https://scholar.google.com/…
relyon plasma GmbH
Osterhofener Str.6
93055 Regensburg
Telefon: +49 (941) 60098-0
Telefax: +49 (941) 60098-100
http://relyon-plasma.com/
![]()
